Par LucieLagarde
Mise à jour le 01-12-2016
Télécharger ce document
→ Téléchargement disponible après inscription
0,00/20
0 Avis > Donne ton avis
421 téléchargements
Le silicium est un élément chimique particulièrement abondant sur Terre. Il se présente sous différentes formes. De nos jours, il intervient dans bon nombre de situations de la vie de tous les jours : matériaux, électronique … sans que nous nous en rendions forcément compte.
Dans le cadre de cette fiche, nous proposons de l’étudier. Dans un premier temps, nous verrons quelques propriétés physico-chimiques de cet élément. Ensuite, nous présenterons ses applications, sans toutefois prétendre être exhaustif. Nous donnerons au passage des détails sur les méthodes industrielles de production du silicium, ainsi que sur les semi-conducteurs.
Prérequis : De par les applications du silicium, cette fiche aborde des notions de physique des matériaux, de cristallographie, de chimie des polymères, de mécanique quantique, d’électronique … En conséquence, des notions préalables dans ces thématiques sont conseillées, mais la fiche reste accessible à un très large public
Télécharger le document pour voir cette partie
Comme les autres éléments du groupe 14 (dont le carbone), le silicium est un cristallogène : il peut exister sous forme cristalline. Pour le carbone, il s’agit du diamant, qui possède une structure cristalline caractéristique. Le silicium possède également cette structure cristalline lorsqu’il est pur. Le paramètre de la maille a, c'est-à-dire la longueur d’une arrête du cube, est de 0,543 071 0 nm.
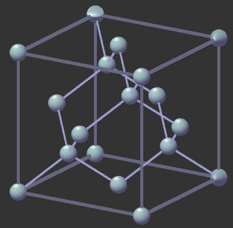
Structure cristalline du silicium
Le module de Young du silicium est compris entre 130 et 185 GPa, à comparer à celui de l’aluminium (69 Gpa), de l’acier (aux alentours de 200 GPa) ou du diamant (environ 1 100 GPa). On rappelle que le module de Young E est une constante intervenant dans la loi de Hooke . Cette dernière établit un lien entre la contrainte exercée (en Pa) en traction sur un matériau et son allongement
(sans dimension), où
est l’augmentation de longueur du matériau dont la longueur initiale est L (en mètre). Un matériau possédant un module de Young élevé est dit rigide.
Télécharger le document pour voir cette partie
Dans la Nature, le silicium se rencontre majoritairement sous forme de dioxyde de silicium , la silice. On parle de silicates pour désigner les minéraux dans lesquels la silice est combinée à des oxydes métalliques. Les silicates sont les composants principaux de la croûte terrestre.
La silice se présente sous deux formes : cristalline et amorphe. On rappelle que sous forme cristalline, les atomes sont disposés de manière régulière, afin de former un motif (une maille) qui se répète au sein du cristal. Au contraire, sous forme amorphe, la disposition des atomes n’est pas régulière.
Sous forme cristalline, la silice est par exemple le principal constituant du quartz. Le quartz est un composant important de la lithosphère. Il possède des propriétés piézoélectriques. Cela signifie que si l’on le déforme, une différence de potentiel apparaît aux extrémités du matériau. Inversement, si l’on lui impose une tension électrique, il se déforme. En électronique, cette propriété du quartz est exploitée afin de s’en servir comme oscillateur, en le faisant vibrer à sa fréquence de résonance (montres à quartz).
Le sable est particulièrement riche en silice. En effet, il résulte de la désagrégation de roches, elles-mêmes étant constituées de silicates, dont le quartz. Les applications actuelles du sable sont nombreuses : matériau de construction (maçonnerie …), filtre, abrasif, … ainsi que la confection du verre de silice, qui est le verre minéral que l’on utilise quotidiennement.
Plus précisément, le verre est fabriqué en chauffant du sable mélangé à du carbonate de sodium et du calcaire à environ 2000 °C, ce qui a pour effet de le faire fondre. Il est fréquemment mélangé à d’autres matériaux afin d’obtenir un verre ayant les propriétés voulues (solidité …). En phase liquide, la silice n’est plus sous forme cristalline mais sous forme amorphe. Si l’on refroidit le mélange assez vite, cet état amorphe subsiste une fois le matériau solidifié, et l’on obtient le verre. D’un point de vue chimique, celui-ci est quasi-inerte. Seul l’acide fluorhydrique peut le dissoudre. Il est transparent pour les longueurs d’onde du visible. Par contre, il absorbe dans l’infrarouge et dans l’ultraviolet. Le verre de silice présente des applications très diverses : vitrages, lentilles optiques, récipients, communications (fibres optiques), matériaux de construction (laine de verre, fibre de verre), stockage de déchets radioactifs par vitrification …
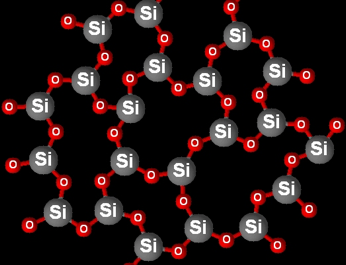
Structure amorphe du verre.
Notons que le verre est également produit dans la Nature :
Hormis ce que nous venons de voir, nous pouvons également citer une autre application de la silice : le gel de silice. Celui-ci se présente habituellement sous forme de petites billes. Le gel de silice est un absorbeur d’humidité, utilisable pour conserver des aliments, des médicaments, ou protéger des appareils électroniques. Il intervient également dans les litières pour chat, en en chimie lors de chromatographies sur couche mince ou sur colonne.
Télécharger le document pour voir cette partie
Le silicium se présente rarement sous la forme d’un corps pur dans la Nature, mais sous forme de silice, comme vu plus haut. Or, nous avions constaté avec la synthèse des silicones qu’il peut être nécessaire d’extraire le silicium de la silice. En outre d’autres applications requièrent elles aussi du silicium, quelquefois avec un degré de pureté très fort. Dans cette partie, nous allons voir les méthodes industrielles employées pour extraire le silicium et le purifier.
On parle de silicium métallurgique pour désigner le silicium extrait de la silice par un procédé de métallurgie. Le silicium n’étant pas un métal, le terme métallurgique se réfère en effet au processus d’extraction du silicium, comparable à celui mis en œuvre pour les métaux (zinc, fer) ou alliage (aciers), c'est-à-dire une carboréduction de l’oxyde à traiter, à hautes températures. La silice est introduite dans un four à arc électrique. Dans la pratique, elle provient de galets, de morceaux de quartz, etc., laquelle est mélangée à des sources de carbone. Des électrodes en carbone portent alors le matériau à des températures de l’ordre de 3000 °C. La silice est réduite en silicium, selon la réaction globale :
La pureté du silicium obtenu est d’environ 98 % ou 99%. Réduit en poudre, il peut être utilisé pour la fabrication des silicones dont nous avions parlé. Sous formes de morceaux, il est utilisable pour réaliser des alliages avec des métaux, comme l’alliage aluminium-silicium servant à la confection de pièces dans les secteurs aéronautiques et automobiles. La fabrication du ferrosilicium (alliage fer/silicium), utilisé en sidérurgie, s’effectue selon le même procédé que nous venons de décrire. La seule différence est du fer est introduit dans le four à arc électrique contenant la silice.
Notons que lors du processus décrit, de la poussière de silice amorphe est produite. Celle-ci peut être captée par filtrage des gaz quittant le four, et utilisée pour la confection de bétons hautes performances.
Télécharger le document pour voir cette partie
Du silicium pur peut être produit par exemple par dépôt chimique en phase vapeur (CVD : chemical vapor deposition). Pour cela, les gaz silane ou trichlorosilane
sont injectés dans un four où règne des basses pressions mais des hautes températures. Sous l’effet de la chaleur,
et
se dissocient. Le silicium ainsi libéré se dépose alors sur les parois sur lequel il forme une couche mince. Selon la méthode utilisée, la couche de silicium peut être monocristalline, polycristalline ou amorphe. Ces trois types sont utilisés pour la confection de cellules photovoltaïques, décrites plus loin dans ce document. Le terme d’amorphe, déjà rencontré pour la silice, signifie également que les atomes de silicium sont disposés au sein du matériau de manière non régulière, à la différence d’un cristal. Cela implique que certains atomes de silicium ne sont reliés qu’à trois autres atomes. Dans la pratique, pour le silicium amorphe, il est alors courant que combler ces manques avec des atomes d’hydrogène, afin d’assurer les qualités électriques du matériau.
Télécharger le document pour voir cette partie
Comme son nom l’indique, du silicium monocristallin est un échantillon macroscopique formé d’un seul cristal. Autrement dit, si le cristal est orienté d’une certaine manière en un point d’un matériau, cette orientation sera la même en tout autre point dudit matériau.
Un matériau monocristallin est obtenu par épitaxie. Cela consiste à mettre en présence un échantillon cristallisé (germe) au contact d’atomes libres, se trouvant en phase gazeuse ou liquide. Au fur et à mesure, lesdits atomes libres se déposent sur le cristal, en adoptant la même structure cristalline que lui. On parle de croissance cristalline pour désigner ce phénomène.
Pour le silicium, cette méthode est utilisable de deux manières : en phase gazeuse ou en phase liquide. En phase gazeuse, cela concerne une CVD avec présence d’un germe. Cette technique est lente et couteuse dans le cadre du silicium monocristallin. En phase, liquide, il s’agit du procédé de Czochralski. Dans cette méthode, le silicium à traiter est fondu. Le germe monocristallin est amené au niveau de la surface du silicium fondu alors qu’il est en train de se solidifier. Par épitaxie, l’environnement proche du germe adopte alors la structure monocristalline. On élève alors légèrement le germe. Le silicium venant de cristalliser propage alors ladite structure cristalline au silicium situé au-dessous. On élève ensuite le germe, et ainsi de suite. En fin de processus, on obtient un cylindre de silicium très pur. Le procédé de Czochralski est assez répandu et est relativement bon marché.
Télécharger le document pour voir cette partie
Quand un atome est isolé, ses électrons occupent des niveaux d’énergie discrets, tel que le montre la mécanique quantique. Quand deux atomes sont liés par une liaison chimique, lesdits niveaux électroniques sont légèrement dédoublés. Quand N atomes sont liés, les niveaux sont divisés en N états très proches. Dans un cristal, on admet que N tend vers l’infini, de sorte que les niveaux d’énergie forment alors des bandes d’énergies. La bande la plus énergétique totalement remplie à température nulle (T = 0K) est la bande de valence. La bande située juste au-dessus est la bande de conduction.
Dans un matériau conducteur électrique, la bande de valence et la bande de conduction sont partiellement superposées. Il en résulte que des électrons sont mis en commun à l’ensemble du cristal, ce qui permet la conduction du courant électrique. Les métaux sont dans ce cas. La tendance générale est que quand la température augmente, l’agitation thermique gêne ce mouvement des électrons, ce qui implique une diminution de la conductivité du matériau.
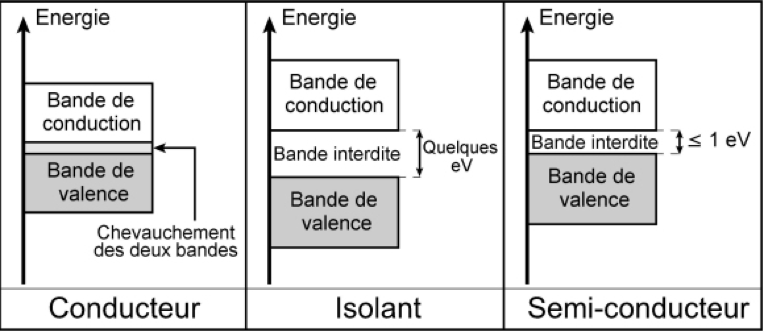
Théorie des bandes.
A l’opposé, quand les bandes de conduction et de valence sont non superposées, une bande interdite est présente entre ces deux bandes. On appelle « gap » d’énergie la largeur de ladite bande interdite. Dans un isolant électrique, la valeur de ce gap dépasse plusieurs électronvolts, où . En conséquence, quelle que soit la température, les électrons de valence ne sont pas capables de passer sur la bande de conduction, ce qui confère au matériau sa capacité d’isolant électrique.
Les semi-conducteurs ont une structure électronique voisine de celle des isolants électriques. La seule différence est que leur gap est de l’ordre de l’électronvolt. Ainsi, quand la température augmente, de plus en plus d’électrons de la bande de valence passent sur la bande de conduction, à cause de l’agitation thermique. La conductivité du matériau augmente alors, mais il reste un mauvais conducteur.
Télécharger le document pour voir cette partie
Quand une jonction PN est polarisée en inverse (borne + d’un générateur appliquée sur la zone N et borne – sur la zone P), le champ électrique imposé par le générateur renforce le champ électrique interne de la jonction, refoulant ainsi davantage les électrons et les trous de la zone de déplétion. Cela empêche alors le courant électrique de passer dans la jonction, qui est alors bloquée. A l’opposé, quand la jonction est polarisée en direct (+ sur P et – sur N), le champ électrique provoqué par le générateur arrive à compenser le champ interne. Les électrons et les trous peuvent alors traverser la jonction, les uns en sens inverse des autres, rendant alors la jonction passante.
Une jonction PN peut donc être utilisée pour imposer un sens à un courant électrique. Elle est à la base du fonctionnement des diodes utilisées en électronique et en électricité, par exemple pour redresser un courant (convertir un courant alternatif en courant continu). En outre, lorsqu’un électron et un trou se combinent, cela correspond à une transition électronique dudit électron. Cette transition peut être radiative, c'est-à-dire correspondre à l’émission d’un photon. Cet effet est mis à profit dans les diodes électroluminescentes (DEL, ou LED en Anglais). Les longueurs d’onde émises sont liées au gap de la bande interdite. Ainsi, le choix du semi-conducteur utilisé aura une incidence sur la couleur émise par la diode.
D’autre part, si l’on interpose une fine zone P entre deux zones N, on obtient un transistor bipolaire dit NPN . Ce composant comporte trois connexions : l’émetteur E, la base B et le collecteur C. On connecte C à la borne + d’un générateur et E à la borne –. Si B n’est pas connectée ou portée à un potentiel électrique négatif, le transistor est bloqué. Cela s’explique aisément en disant que la jonction PN entre C et B est polarisée en inverse. Par contre, si B est alimentée en la reliant à une borne + (potentiel électrique positif), des électrons sont émis par l’émetteur E (d’où son nom), passent à travers la jonction PN entre E et B, puis diffusent à travers la zone P. Certains quittent le transistor à travers B, ce qui induit l’apparition d’un courant de B vers E. Toutefois, une partie non négligeable des électrons, entre 95 % et 99,5 % , est également captée par la jonction PN entre B et C, et est collectée par le collecteur C (d’où son nom), ce qui provoque un courant
. Le transistor est ainsi passant. On a
. Les transistors sont utilisables en tant que commutateurs (interrupteurs commandés électriquement). Ils peuvent également amplifier des signaux électriques.
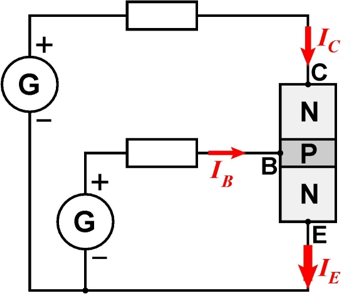
Transistor NPN dans un circuit électrique.
Télécharger le document pour voir cette partie
I. Introduction
II. Généralités sur le silicium
1) L'atome de silicium
2) Structure cristalline
3) Propriétés physico-chimiques
III. Le silicium associé à l'élément oxygène
1) La silice
2) Le silicone
IV. Production du silicium
1) Le silicium métallurgique
2) Traitements chimiques
3) Production de silicium par dépôt
4) Le silicium polycristallin
5) Le silicium monocristallin
6) Purification du silicium monocristallin
V. Le silicium en tant que semi-conducteur
1) Les semi-conducteurs
2) Dopage d'un semi-conducteur : création d'une jonction PN
3) Les diodes et le transistor
4) La cellule photovoltaïque
Télécharger ce document
Questions / Réponses
EN DIRECT DES FORUMS
16777689 messages 16778264 réponses